Annonsørinnhold kun for helsepersonell
BRYSTKREFT: Adjuvant behandling til HR+, HER2- sykdom med høy risiko for tilbakefall
Pasienter med HR-positiv, HER2-negativ tidlig brystkreft har risiko for tilbakefall. Kan risikoen reduseres?
I desember 2024 ble abemaciklib (Verzenios) i kombinasjon med endokrin terapi (ET) godkjent av Beslutningsforum for adjuvant behandling av HR-positiv, HER2-negativ, lymfeknutepositiv tidlig brystkreft med høy risiko for tilbakefall. Verzenios + ET er vist å kunne betydelig redusere tilbakefallsrisikoen for denne gruppen.1
Den totale tilbakefallsraten for HR-positiv, HER2-negativ tidlig brystkreft er estimert til 20–30 % over tid.2 For pasienter med høyrisikokarakteristika er 5-års risikoen for tilbakefall 29,8 % – tilsvarende en tredoblet risiko sammenlignet med pasienter uten slike risikofaktorer.3
Nå får denne gruppen tilgang på en behandling som kan redusere risikoen for tilbakefall.1
Slik fungerer Verzenios
Abemaciklib undertrykker tumorvekst ved å hindre fosforylering av retinoblastomprotein gjennom hemming av CDK4 og CDK6.5 Verzenios er den eneste CDK4/6-hemmeren som doseres kontinuerlig («continous exposure»), med to års behandlingsvarighet i adjuvant setting.4,5
Effekten av kontinuerlig dosering ble undersøkt i den randomiserte, åpne kliniske fase 3-studien monarchE, hvor totalt 5637 pasienter ble randomisert 1:1 til å motta enten Verzenios 150 mg (to ganger daglig) pluss legens valg av endokrin behandling eller standard ET alene.1
Studien har 2 kohorter, hvorav kohort 1 (91 % av pasientene, n=5120) er grunnlaget for godkjenning i EMA.1,6 Høy risiko er her definert som 4+ positive lymfeknuter eller 1–3 positive lymfeknuter og enten tumorstørrelse >5 cm eller histologisk grad 3.4 Det primære endepunktet var invasiv sykdomsfri overlevelse (IDFS).
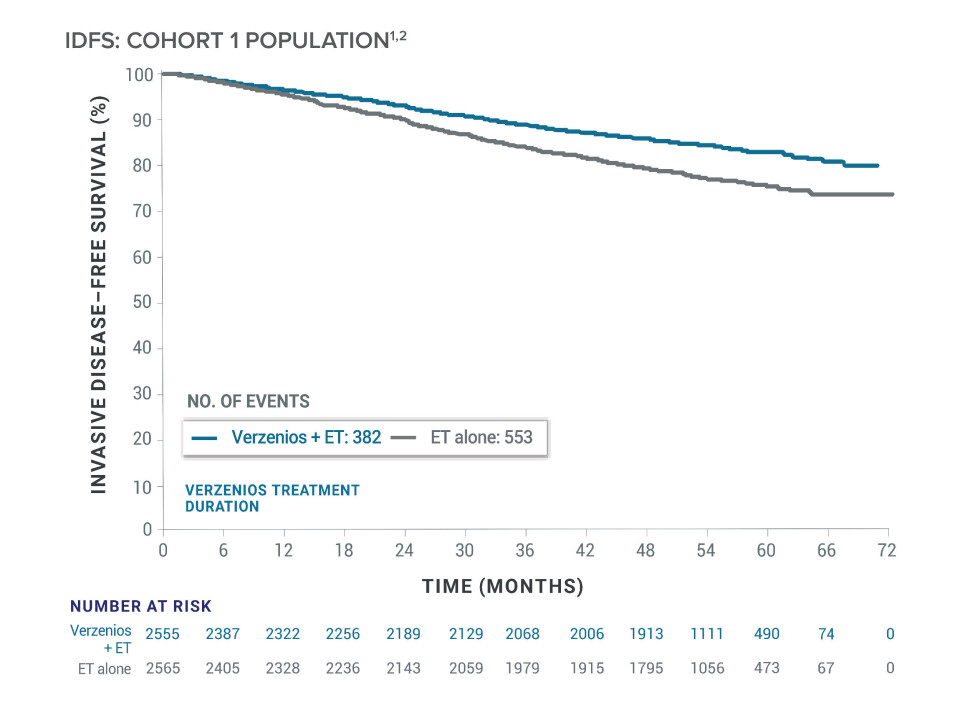
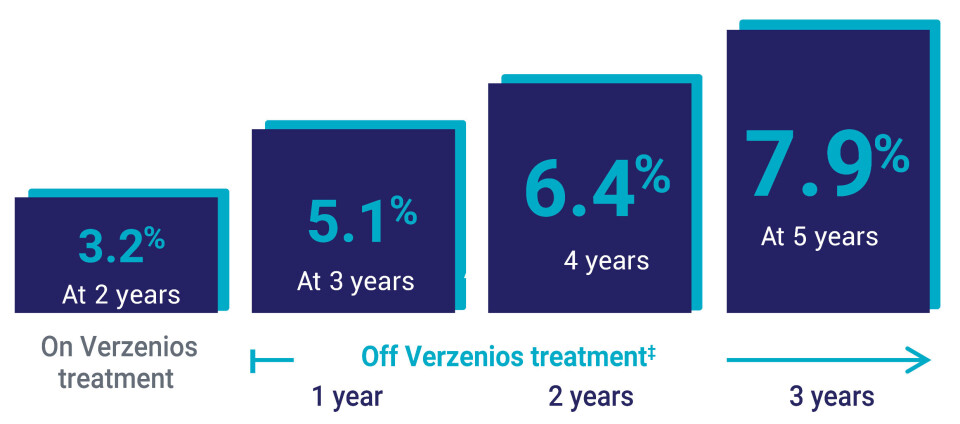
Etter 5 år viste Verzenios-gruppen i denne kohorten 33 prosent redusert risiko for tilbakefall sammenlignet med dem som ble behandlet med ET alene (HR=0,670 (95 % CI: 0,588–0,764).1 Ved 5-årsanalysen hadde omtrent 80 % av pasientene vært fulgt i minst 4 år, tilsvarende to år etter fullført behandling. Den vedvarende effekten gav seg utslag i at forskjellen mellom gruppene fortsatte å øke over tid – fra 3,2 % absolutt forskjell i IDFS ved år 2 til 7,9 % ved år 5.1
Dette sier retningslinjene
National Comprehensive Cancer Network (NCCN) anbefaler to år med adjuvant abemaciklib i kombinasjon med endokrin terapi for pasienter med HR+, HER2–, lymfeknutepositiv, høyrisiko tidlig brystkreft.7
I ASCOs retningslinjer er abemaciklib den eneste CDK4/6-hemmeren som er sterkt anbefalt for behandling av denne pasientgruppen.8 Også ESMO anbefaler adjuvant behandling med abemaciklib.9
I den siste oppdateringen av Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med brystkreft (mars 2025) ble abemaciklib inkludert. Her anbefales bruk av adjuvant abemaciklib til pasienter med enten pN2/pN3 sykdom eller pN1 og enten grad 3 eller T3 tumorstørrelse.10
Bivirkninger og dosering
Diaré er den vanligste bivirkningen ved behandling med Verzenios.5 Forekomsten var høyest den første måneden av behandlingen med abemaciklib og deretter lavere, og i monarchE var median tid til første forekomst av diaré av enhver grad 8 dager.5 Median varighet av diaré var 7 dager for grad 2 og 5 dager for grad 3.5
Pasienter bør starte behandling med midler mot diaré, som loperamid, ved første tegn på løs avføring, øke væskeinntaket og informere helsepersonell. Dosejustering anbefales hos pasienter som utvikler ≥ grad 2 diaré.5 Dosejustering er anbefalt basert på individuelle behov og toleranse.5 Hvis nødvendig skal dosen reduseres med 50 mg om gangen – følg anbefalinger etter grad i SPC.
Blant de 2791 pasientene som ble behandlet med abemaciklib, hadde 832 (30 %) én dosereduksjon og 389 (14 %) hadde to dosereduksjoner. Pasienter ≥ 65 år eller med ≥ 4 eksisterende komorbiditeter hadde høyere sannsynlighet for å få dosereduksjon.9 Effekten av Verzenios vedvarte etter dosejustering.5,11–12
18,5 % av pasientene i studien avsluttet behandlingen på grunn av bivirkninger.12 5,3 % avsluttet på grunn av diaré.13
Andre hyppig rapporterte bivirkninger er infeksjoner, nøytropeni, leukopeni, anemi, fatigue, kvalme, oppkast, alopesi og nedsatt appetitt.5
Indikasjoner
Tidlig brystkreft
Verzenios, i kombinasjon med endokrin behandling, er indisert til adjuvant behandling av voksne pasienter med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ, lymfeknutepositiv tidlig brystkreft med høy risiko for tilbakefall. Hos pre- eller perimenopausale kvinner, bør endokrin behandling med aromatasehemmer kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.
Avansert eller metastatisk brystkreft
Verzenios er indisert til behandling av kvinner med hormonreseptor (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ lokalavansert eller metastatisk brystkreft i kombinasjon med en aromatasehemmer eller fulvestrant som innledende endokrinbasert behandling, eller hos kvinner som tidligere har fått endokrin behandling. Hos pre- eller perimenopausale kvinner bør endokrin behandling kombineres med en LHRH‑agonist.
Dosering
Anbefalt dose abemaciklib er 150 mg to ganger daglig når det brukes i kombinasjon med endokrin behandling. Tablettene skal tas hele. Tidlig brystkreft: Verzenios bør tas kontinuerlig i to år, eller inntil tilbakefall av sykdom eller uakseptabel toksisitet oppstår. Avansert eller metastatisk brystkreft: Verzenios bør tas kontinuerlig så lenge pasienten har klinisk nytte av behandlingen eller inntil uakseptabel toksisitet inntreffer. Dersom en pasient kaster opp eller går glipp av en dose med Verzenios, skal pasienten informeres om at neste dose tas til vanlig tid. En ekstra dose skal ikke tas.
Kontraindikasjoner
Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene listet opp i pkt. 6.1 i SPC.
Bivirkninger
De vanligst forekommende bivirkningene er diaré, infeksjoner, nøytropeni, leukopeni, anemi, fatigue, kvalme, oppkast, alopesi og nedsatt appetitt. Bivirkninger av grad ≥ 3 stod for mindre enn 5 % av de vanligste bivirkningene, med unntak av nøytropeni, leukopeni og diaré.
Utvalgte forsiktighetsregler
Dosejustering anbefales hos pasienter som utvikler grad 3 eller 4 nøytropeni. Pasienten må bes om å rapportere ethvert tilfelle av feber til helsepersonell. Pasienten bør overvåkes for tegn på infeksjon, dyp venetrombose og lungeembolisme. og hensiktsmessig medisinsk behandling gis. Nytte og risiko ved å fortsette behandling med abemaciklib hos pasienter som opplever alvorlig arterielle tromboemboliske hendelser bør vurderes. Basert på nivået av økningen av ALAT eller ASAT, kan det være nødvendig med dosejustering av abemaciklib. Diaré kan være forbundet med dehydrering. Behandling med antidiarroika, bør startes ved første tegn på løs avføring, væskeinntaket økes og helsepersonell informeres. Samtidig bruk av CYP3A4-induktorer bør unngås på grunn av risikoen for nedsatt effekt av abemaciklib. Pasienter skal følges opp for lungesymptomer som kan indikere ILD/pneumonitt, og gis hensiktsmessig medisinsk behandling. Verzenios er ikke anbefalt under graviditet og hos fertile kvinner som ikke bruker prevensjon under og i minst tre uker etter avsluttet behandling. Pasienter som får abemaciklib bør ikke amme.
REFUSJON OG PRISER:
Reseptgruppe C. Pakninger og priser per 02.09.2024: 50 mg: 28 stk. kr 21267,60. 100 mg: 28 stk. kr 21267,60. 56 stk. kr 42498,90. 150 mg: 28 stk. kr 21267,60. 56 stk. kr 42498,90. Avansert eller metastatisk brystkreft er godkjent av Beslutningsforum og er inkludert i 2407 Onkologi. Tidlig Brystkreft er godkjent av Beslutningsforum. Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
For fullstendig informasjon vennligst se FK-tekst eller SPC. Eli Lilly Norge A.S., Innspurten 15 0663 Oslo, Telefon: 22 88 18 00
Referanser: Verzenios (abemaciklib) SPC, 17.06.2024, seksjon 4.1, 4.2, 4.3, 4.4, 4,5, 4.6, 4.8
Referanser
1. Rastogi P, O'Shaughnessy J, Martin M, Boyle F, Cortes J, Rugo HS, Goetz MP, Hamilton EP, Huang CS, Senkus E, Tryakin A, Cicin I, Testa L, Neven P, Huober J, Shao Z, Wei R, André V, Munoz M, San Antonio B, Shahir A, Harbeck N, Johnston S. Adjuvant Abemaciclib Plus Endocrine Therapy for Hormone Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative, High-Risk Early Breast Cancer: Results From a Preplanned monarchE Overall Survival Interim Analysis, Including 5-Year Efficacy Outcomes. J Clin Oncol. 2024 Mar 20;42(9):987-993. doi: 10.1200/JCO.23.01994. Epub 2024 Jan 9. Erratum in: J Clin Oncol. 2024 Jun 10;42(17):2111. doi: 10.1200/JCO.24.00711. Erratum in: J Clin Oncol. 2025 Jan;43(1):113. doi: 10.1200/JCO-24-02469. PMID: 38194616; PMCID: PMC10950161.
2. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Lancet. 2005;365(9472):1687-1717
3. Sheffield KM, Peachey JR, Method M, et al. A real-world US study of recurrence risks clinicopathological features in HR-positive, HER2-negative early breast cancer. Future Oncol. 2022;18(21):2667-2682. doi:10.2217/fon-2022-0310
4. Johnston SRD, Toi M, O’Shaughnessy J, et al; on behalf of monarchE Committee Members. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial. Lancet Oncol. 2023;24(1):77-90. doi:10.1016/S1470-2045(22)00694-5
5. Verzenios SPC 17.06.2024, pkt. 4,1, 4,2, 4,8, 5,1.
6. Verzenios | European Medicines Agency (EMA). Tilgjengelig fra: https://www.ema.europa.eu/en/medicines/human/EPAR/verzenios
7. Gradishar, W. J., Moran, M. S., Abraham, J., Abramson, V., Aft, R., Agnese, D., Allison, K. H., Anderson, B., Bailey, J., Burstein, H. J., Chen, N., Chew, H., Dang, C., Elias, A. D., Giordano, S. H., Goetz, M. P., Jankowitz, R. C., Javid, S. H., Krishnamurthy, J., Leitch, A. M., Lyons, J., McCloskey, S., McShane, M., Mortimer, J., Patel, S. A., Rosenberger, L. H., Rugo, H. S., Santa-Maria, C., Schneider, B. P., Smith, M. L., Soliman, H., Stringer-Reasor, E. M., Telli, M. L., Wei, M., Wisinski, K. B., Yeung, K. T., Young, J. S., Schonfeld, R., & Kumar, R. (2024). Breast Cancer, Version 3.2024, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 22(5), 331-357. Retrieved Mar 14, 2025, from https://doi.org/10.6004/jnccn.2024.0035
8. Rachel A. Freedman et al. Optimal Adjuvant Chemotherapy and Targeted Therapy for Early Breast Cancer—Cyclin-Dependent Kinase 4 and 6 Inhibitors: ASCO Guideline Rapid Recommendation Update. JCO 42, 2233-2235(2024). DOI:10.1200/JCO.24.00886
9. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up☆ Loibl, S. et al. Annals of Oncology, Volume 35, Issue 2, 159 - 182
10. Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av pasienter med brystkreft. 31.03.25
11. 274P Impact of dose reductions on efficacy of adjuvant abemaciclib for patients with high-risk early breast cancer (EBC): Analyses from the monarchE study O'Shaughnessy, J. et al. Annals of Oncology, Volume 34, S293
12. Rugo HS, Huober J, García-Sáenz JA, et al. Management of abemaciclib-associated adverse events in patients with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: safety analysis of MONARCH 2 and MONARCH 3. Oncologist. 2021;26:e53-e65. doi:10.1002/onco.13531
13. Rugo HS, O’Shaughnessy J, Boyle F, et al. Adjuvant abemaciclib combined with endocrine therapy for high-risk early breast cancer: safety and patient-reported outcomes from the monarchE study. Ann Oncol. 2022;33(6):616-627.
PP-AL-NO-0225.05.2025